在现今快节奏的时代背景下,临研行业也卷入了这“天下武功唯快不破”的角逐中不断奔跑。随着研发环境蓬勃发展、竞争激烈,为了把临床试验启动前的工作做得更为高效精细专业,临床项目启动部门(Study Start Up,SSU)在药企/CRO中应运而生,快速启动成为了项目顺利开展的先决条件,因为大家相信“好的开始是成功的一半”。但启动“不够快”仍然是临床研究的持续吐槽点。到底是谁拖慢了临床研究启动的步伐呢?
机构坐上“被告席”已有多年
多年来行业一直诟病院方机构的流程不清、要求繁琐、沟通拖拉,“门难进、事难办”导致中国临床试验速度从起步就远慢于欧美等其他国家。为了改变大家对机构的“不良”印象,在国家各项利好政策和激励环境下,临床试验机构也“因院制宜”不断突破,纷纷探索质量与速度兼得的解决方案,公开流程、立项前置、伦理互认、合同并行等举措也越发普遍。
卷起来,“没有最快只有更快”
自2017年起,医肿GCP中心探索临床研究中心化运行管理体系建设,以“极早沟通接洽、加快立项效率、伦理-合同-人遗三步并行”等一系列举措,全方位提高我院临床试验启动速度。
我们可喜地看到,经过5年的不断完善优化,据真实数据统计,目前2022年启动的100项IND注册临床试验中,
1. 立项首次提交-立项完成:平均天数4天(自然日),最快0天;
2. 伦理首次提交-伦理通过:平均天数20天(自然日),最快2天;
3. 合同提交-签署完成:平均天数67天(自然日),最快21天。
通过以上数值,内行同道应该可以推测出,利用我院现有的加速启动举措,平均71天(即4+67天)启动项目将妥妥地不成问题。如果各个环节衔接的足够完美,启动医肿临床试验在1个月内也是颇有希望的。

特别说明:
以上数据与上一篇推文数据略有出入,原因在于:
1. 纳入统计范围不同,以上针对当年启动项目信息统计。
2. 总耗时为各环节累计时长,实际情况为伦理与合同可并行以缩短总耗时。
3. 以上统计时间天数为自然日。
机构努力了,but耗时未必都是机构的错
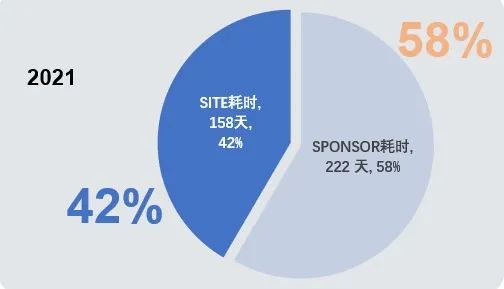
现实情况是否和我们的推测一样么?事实却不尽然。我们发现在100个已启动的临床试验中,从立项开始到项目启动耗时90-500天不等。
时间都去哪儿了?
1. 立项完成-伦理首次提交:平均天数33天(自然日),最快0天;
2. 立项完成-合同首次沟通:平均天数70天(自然日),最快2天;
3. 合同签署完成-项目启动:平均天数71天(自然日),最快3天。
综上所述,我们获得了一个粗略的数学结果,在临床试验项目的启动过程中,机构所耗费的平均总时长≈4+20+67(91天),申办方所耗费的平均总时长≈33+70+71(174天)。在机构优化流程提高效率的同时,申办方缩短自身内部的时间消耗及完美的衔接各个环节,才是达到试验快速启动的制胜法宝。
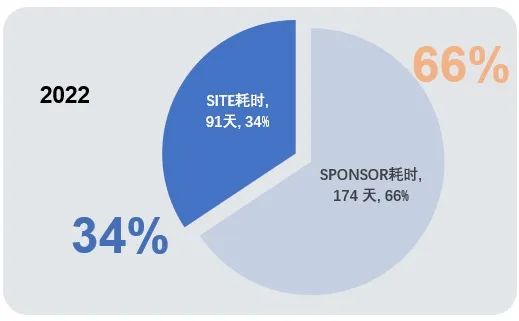
我们不禁要问:亲爱的申办方队友,你们是真着急呢?还是不着急呢?
戏要好看,角色必然相互成就
我们相信没有谁在主动“拖慢”临床研究启动的速度,通过机构与申办方携手并进、良性互卷,利用好相互的优势举措,彼此作相互成就的伙伴,不当相互消耗的对手,一起努力走向速度更快、质量更高,综合能力更强的光明未来。
再次推荐我中心启动加速“关键点”
供申办方参考和行业同道指正
我院立项时必要材料要求明确,接受立项前置于NMPA批件/通知书,在立项审查期间,申办者、研究者与机构之间保持积极沟通,必要时对方案进行一定的解释、补充与修订;
我院实行“伦理审查-合同洽谈-人遗申请”三步并行,无需串联依次进行;
我院是国内首批接受中心伦理的单位,也是北京市伦理互认联盟的首批成员。通过参与资源整合、积极互认的方式,全面实现伦理审查电子化,显著提升伦理审查的效率;
我院对缩短签署时长做出了重要探索,合同前置与伦理并行,给到双方更多的磋商时间;完善合同模板,与长期合作方建立框架协议,将尽量多的条款标准化、固定化,有助于提升双方的工作效率。
申办者提前出发,在立项之后尽快开始签署流程是跑赢快启的制胜法宝。
(注:具体细节要求,均可参考医肿GCP中心官方公众号NCCGCP1962)

 010-64929757
010-64929757  service@gcpunion.org
service@gcpunion.org  北京市北三环中路朝阳区安外小关北里43号渔阳置业大厦A座706
北京市北三环中路朝阳区安外小关北里43号渔阳置业大厦A座706 
