我国恶性肿瘤发病占全球23.9%,恶性肿瘤死亡占我国居民死亡的23.9%,恶性肿瘤是威胁我国人民健康的重大公共卫生问题。在中共中央、国务院印发的《“健康中国2030”规划纲要》文件中明确提出,到2030年总体癌症5年生存率提高15%。加强并完善肿瘤药物研发布局、促进肿瘤患者药物可及性是提升我国肿瘤综合防控能力的重中之重
为充分发挥国家队战略咨询作用,中国医学科学院与国家药品监督管理总局、国家癌症中心与药品审评中心开展密切合作,汇总并权威发布我国肿瘤药物临床试验研究年度布局及上市肿瘤药物概况。
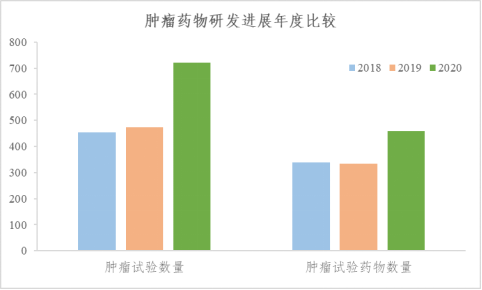
一、飞速发展,2020年肿瘤药物试验抗疫不停工
2020年,我国肿瘤药物临床试验研发布局及上市产品均未受疫情影响,保持高增长速度。具体而言,临床试验、试验药物及上市药物增速分别为52.3%(474种vs.722项)、36.7%(335种vs.458种)、11.8%(17种vs.19种)。
二、满足需求,肿瘤新药上市数量创新高
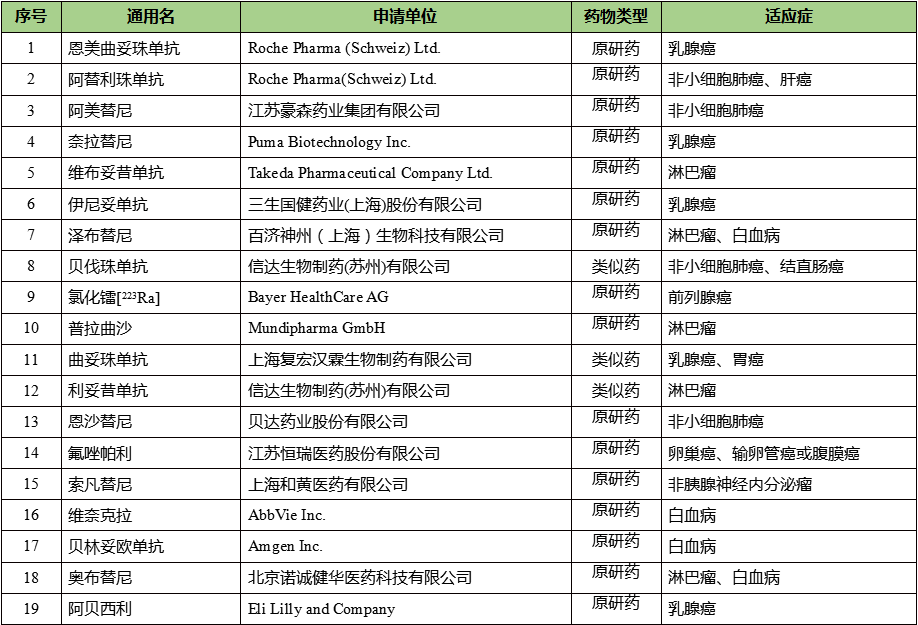
2020年,共有17家制药企业(国内制药企业9家,全球制药企业8家)的19种抗肿瘤药在中国获准上市,包括16种原研药,3种生物类似药,相较2019年(17种)和2018年(15种)均有增长。
2020年中国批准上市抗肿瘤药物情况
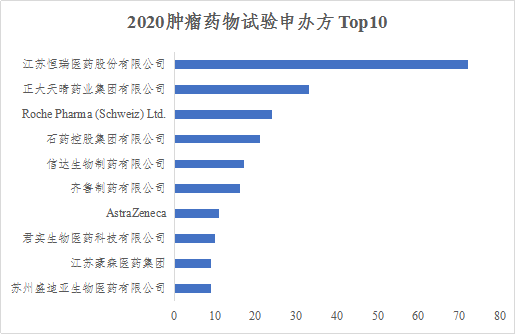
三、中流砥柱,国内企业积极推动肿瘤药物试验
国内制药企业是推动中国肿瘤药物临床试验发展的中坚力量,在布局的肿瘤试验数量、试验药物品种和上市药物品种占比分别达83.5%(603/722)、85.8%(393/458)和52.6%(10/19)。从各制药企业注册的肿瘤药物试验数量来看,江苏恒瑞最多,Top10制药企业汇总如下。
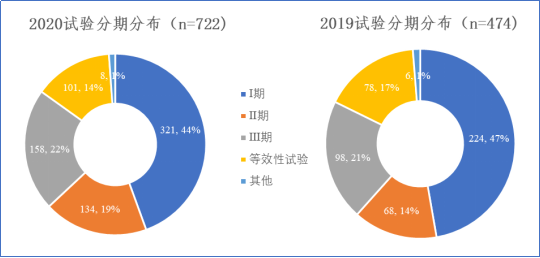
四、重视创新,I期研究占据主体地位
与2019年相比,2020年注册的722项肿瘤药物临床试验研究分期构成均未见明显变化,Ⅰ期试验占据主体地位(321项,44.5%)。
五、百花齐放,靶向免疫细胞治疗多重出击
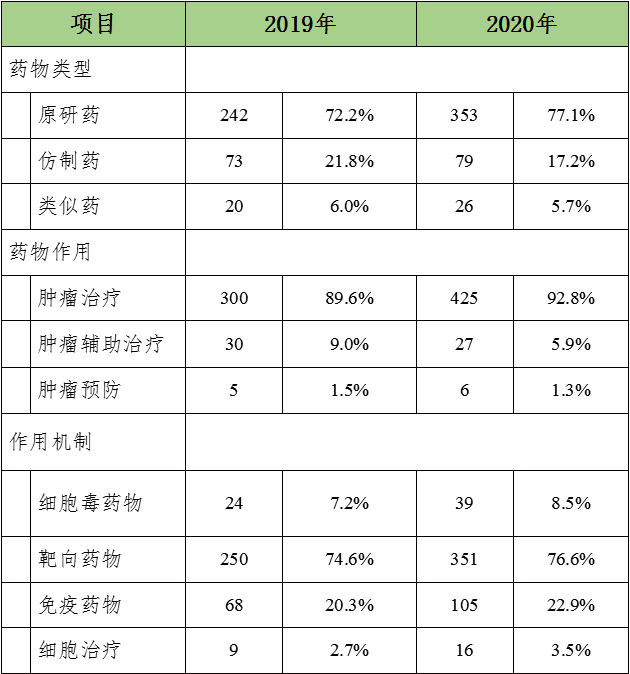
与2019年相比,2020年涉及的458种肿瘤试验药物类型、药物作用及作用机制构成上均未见明显变化。原研药(353种,77.1%)和肿瘤治疗药物居多(425种,92.8%);机制方面,靶向药最为常见(351,76.6%),其次为免疫药(105,22.9%),另有16项细胞治疗试验。涉及试验药物超过10种的靶点共有4个,依次为PD-1(24种),EGFR(21种)、PD-L1(13种)和HER-2(13种)。
2020 vs.2019中国肿瘤试验药物分布
六、广泛覆盖,多瘤种药物研发有望
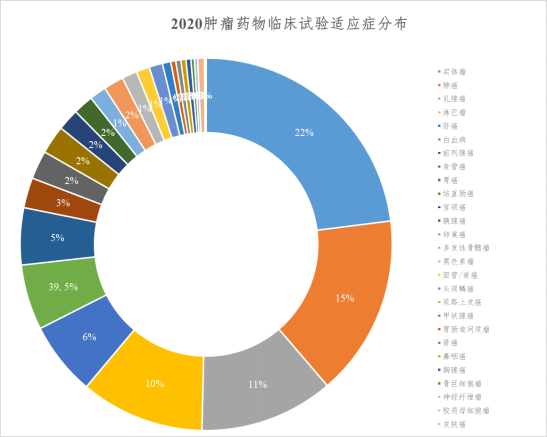
2020年肿瘤注册药物临床试验共涉及适应症27种,居前10位的依次为实体瘤158项(21.9%),肺癌108项(15.0%),乳腺癌80项(11.1%),淋巴瘤74项(10.2%),肝癌44项(6.1%),白血病39项(5.4%),前列腺癌34项(4.7%)、食管癌18项(2.5%)、胃癌17项(2.4%)和结直肠癌17项(2.4%)。
七、研究机构,备案制及能力建设初见成效
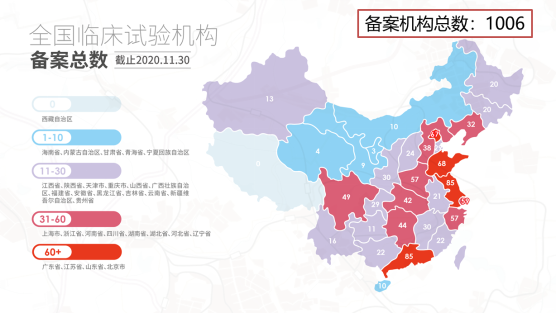
2019年12月1日,药物临床试验机构正式实施备案制,备案机构增加至1006,新增166家,其中进行肿瘤专业备案的机构数为535家。2020年肿瘤药物临床试验研究共涉及牵头单位118家,比2019年增加了10家。

参考文献
2020年中国肿瘤药物临床试验进展.《中华肿瘤杂志》2021年2月刊. DOI: 10.3760/cma.j.cn112152-20201221-01089

 010-64929757
010-64929757  service@gcpunion.org
service@gcpunion.org  北京市北三环中路朝阳区安外小关北里43号渔阳置业大厦A座706
北京市北三环中路朝阳区安外小关北里43号渔阳置业大厦A座706 
